Институт молекулярной биологии и генетики



 Костарева Анна Александровна
Костарева Анна АлександровнаДиректор Института молекулярной биологии и генетики, профессор кафедры факультетской терапии с клиникой Института медицинского образования Центра Алмазова, специалист отдела сопровождения разработки ВИМИС ССЗ, д.м.н.
Основная деятельность
Основные научные направления института лежат в области изучения молекулярно-генетических основ патогенеза заболеваний сердечно-сосудистой системы, а также разработке и усовершенствовании методов обследования и лечения пациентов с сердечно-сосудистыми заболеваниями.
Основные направления работы
- Изучение молекулярных механизмов развития кардиомиопатий и врожденных пороков сердца
- Изучение молекулярных и клеточные механизмов нарушения ритма и дисфункции ионных каналов
- Изучение молекулярных механизмов развития заболеваний аорты и аортального клапана
- Разработка клеточных моделей для изучения патогенеза заболеваний сердечно-сосудистой системы на основе индуцированных плюрипотентных стволовых клеток (иПСК) и стромальных клеток миокарда
- Тканевая инженерия кровеносных сосудов и клапанов сердца
- Исследование молекулярно-генетических предпосылок развития метаболического синдрома, ожирения и нарушения углеводного обмена
- Исследование роли микроРНК и микрочастиц в межклеточной сигнализации и регуляции экспрессии генов
- Исследование механизмов направленной дифференцировки прогениторных клеток и фундаментальных основ регенерации
Структура института
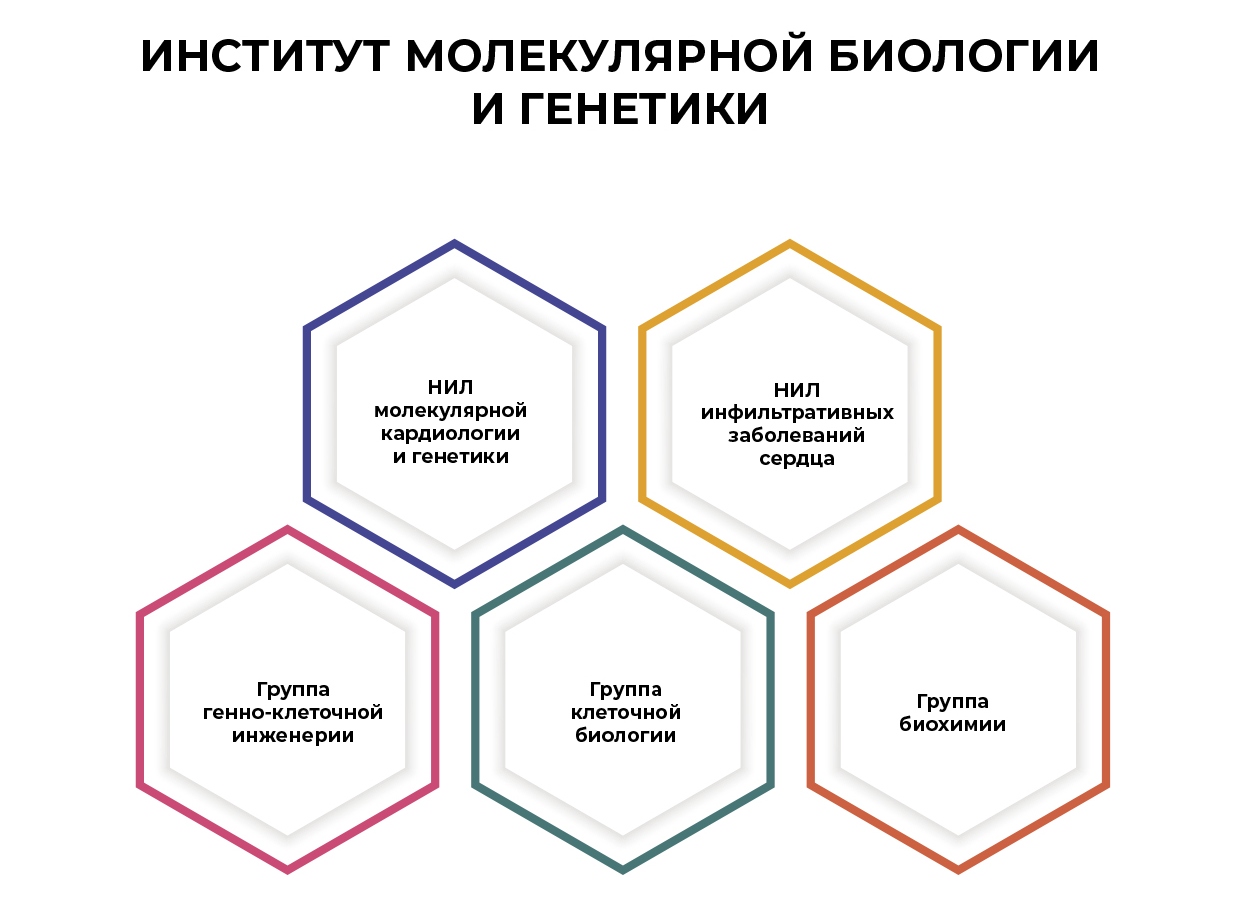
Научные подразделения
- НИЛ молекулярной кардиологии и генетики
- НИО атеросклероза
— НИЛ молекулярно-клеточных механизмов атеросклероза
— НИЛ биохимии - Группа клеточной биологии
- НИО инфильтративных заболеваний сердца
— Группа тканевой патологии
— Группа амилоидоза
— Группа протеомики - Группа клеточных технологий
- Группа генно-клеточной инженерии
Текущие проекты Института
- Механизмы активации регенеративного потенциала мезенхимных клеток сердца
Реализуется в рамках направления по исследованию механизмов направленной дифференцировки прогениторных клеток и фундаментальных основ регенерации, в виде инициативной темы группой молекулярной кардиологии и генетики.
- Исследование эффекта мутаций в гене LMNA на электрофизиологические свойства кардиомиоцитов
Реализуется в рамках направления по изучению молекулярных механизмов развития кардиомиопатий и врожденных пороков сердца группой клеточной биологии, проект НЦМУ. - Изучение механизмов, опосредующих процессы остеогенной дифференцировки клеток
Реализуется в рамках направления по изучению молекулярных механизмов развития заболеваний аорты и аортального клапана группой молекулярной кардиологии и генетики, проект НЦМУ.
- Тестирование эффектов сочетанного применения периодической пневматической компрессии и программируемой электромиостимуляции для лечения нарушений артериального кровотока в конечностях
Реализуется в рамках направления по исследованию механизмов направленной дифференцировки прогениторных клеток и фундаментальных основ регенерации группой инфильтративных заболеваний сердца (группой амилоидоза), государственное задание. - Изучение механизмов нарушения регенерации и метаболизма скелетной мускулатуры при сердечно-сосудистых заболеваниях, в том числе при хронической сердечной недостаточности и ламинопатиях
Реализуется в рамках направления по исследованию механизмов направленной дифференцировки прогениторных клеток и фундаментальных основ регенерации группой клеточной биологии, государственное задание, проект НЦМУ, инициативная тема. - Разработка клеточных моделей дегенерации скелетной мускулатуры, поиск терапевтических мишеней для профилактики и лечения мышечной дегенерации
Реализуется в рамках направления по исследованию механизмов направленной дифференцировки прогениторных клеток и фундаментальных основ регенерации группой клеточной биологии, проект НЦМУ. - Биоинформатический анализ данных, полученных в биологических экспериментах
Реализуется в рамках направления по изучению молекулярных механизмов развития кардиомиопатий и врожденных пороков сердца группой клеточной биологии, проект НЦМУ, грант. - Изучение биофизических характеристик потенциал-зависимых ионных каналов кардиомиоцитов методом локальной фиксации потенциала
Реализуется в рамках направления по изучению молекулярных и клеточных механизмов нарушения ритма и дисфункции ионных каналов группой клеточной биологии, проект НЦМУ, грант. - D. Rerio как модельный объект в исследованиях сердечных каналопатий
Реализуется в рамках направления по изучению молекулярных и клеточных механизмов нарушения ритма и дисфункции ионных каналов группой клеточной биологии, грант. - Структурно-функциональная характеристика натриевых каналов, при различных аритмогенных синдромах.
Реализуется в рамках направлений по изучению молекулярных и клеточных механизмов нарушения ритма и дисфункции ионных каналов и по изучению молекулярных механизмов развития кардиомиопатий и врожденных пороков сердца группой молекулярной кардиологии и генетики, грант. - Тканеинженерные биоматериалы, стимулирующие регенеративный потенциал тканей за счет улучшенной пространственной архитектуры и сниженного воспалительного ответа.
Реализуется в рамках направления по тканевой инженерии кровеносных сосудов и клапанов сердца группой генно-клеточной инженерии, проект НЦМУ. - Внеклеточные везикулы как биомаркеры и регуляторы патологических состояний сердечно-сосудистой системы.
Реализуется в рамках направления по исследованию роли микроРНК и микрочастиц в межклеточной сигнализации и регуляции экспрессии генов группой генно-клеточной инженерии совместно с группой атеросклероза, проект НЦМУ, инициативная тема. - Изучение патогенеза редких, малоизученных и неизвестных ранее заболеваний: персонифицированная генетическая диагностика, биомоделироивание и поиск новых подходов к терапии и определению прогноза
Реализуется в рамках направления по изучению молекулярных механизмов развития кардиомиопатий и врожденных пороков сердца группой молекулярной кардиологии и генетики, проект НЦМУ.
17-04-01318 «Клеточные механизмы патологии восходящего отдела аорты и аортального клапана»; руководитель Малашичева А. Б.
Работа посвящена поиску молекулярных звеньев, вовлечённых в патогенез аневризмы восходящего отдела грудной аорты и кальцификации и аортального клапана – распространённых и опасных сердечно-сосудистых заболеваний человека.
На основании анализа опубликованных данных выдвинута гипотеза о том, что нарушение функционирования магистральных сигнальных путей TGF-beta, Notch, BMP может приводить к нарушению путей передачи сигнала в клетках аорты и аортального клапана при аневризме и кальцификации аортального клапана, к изменениям в экспрессии регуляторных элементов соответствующих сигнальных путей. Для проверки этой гипотезы будет проведено сравнение нескольких типов сосудистых клеток и клеток клапанов здоровых доноров и пациентов с аневризмой восходящего отдела грудной аорты или кальцификацией аортального клапана — с точки зрения активности сигнальных путей TGF-beta, Notch, BMP.
Исходя из полученных результатов, будут сделаны выводы о роли измененной активности этих сигнальных путей и клеточных механизмах в патогенезе аневризм восходящего отдела грудной аорты и кальцификации аортального клапана.
18-315-00177 «Изучение роли внеклеточных митохондриальной ДНК и микроРНК в процессах развития воспаления и фиброзно-жирового замещения миокарда»; руководитель Худяков А. А.
Процессы воспаления, фиброза и жирового замещения миокарда являются частой причиной сердечной недостаточности и внезапной остановки сердца. Несмотря на значительный объем накопленных данных, причины этих изменений до сих пор не установлены.
В последнее время наблюдается рост числа исследований, посвященных биологически активным молекулам, выделяемым клетками во внеклеточную среду, в частности митохондриальной ДНК (мтДНК) и микроРНК. Внеклеточная мтДНК является сильным индуктором воспаления, а секретируемые микроРНК, проникая в клетки, способны регулировать экспрессию их генов, запуская физиологические и патологические процессы.
Целью представленного проекта является сравнительная оценка качественного и количественного состава внеклеточных мтДНК и микроРНК в биологических образцах пациентов с аритмогенной кардиомиопатией и здоровых доноров.
В результате выполнения представленного проекта будет исследовано содержание внеклеточных мтДНК и микроРНК в различных фракциях культуральной среды кардиомиоцитов, дифференцированных из пациент-специфичных индуцированных плюрипотентных стволовых клеток, и фракциях перикардиальной жидкости пациентов с аритмогенной кардиомиопатией и контрольной группы. Будет выполнен сравнительный анализ содержания внеклеточных мтДНК и микроРНК, проведена оценка иммуногенности внеклеточной мтДНК и биоинформатический поиск мишеней выявленных внеклеточных микроРНК среди сигнальных каскадов. Полученные результаты позволят сформулировать гипотезы о роли мтДНК и микроРНК в процессах воспаления, фиброза и жирового замещения и разработать диагностические подходы с использованием перикардиальной жидкости.
18-34-00277 «Notch-зависимые механизмы межклеточных взаимодействий эндотелиальных и мезенхимных клеток»; руководитель Костина А. С.
Проект посвящен изучению взаимодействия эндотелиальных и мезенхимных клеток. С использованием сокультивирования эндотелиальных и мезенхимных клеток будет изучено влияние межклеточных взаимодействий на индукцию остеогенной и гладкомышечной дифференцировки. Будет проанализирована роль сигнального пути Notch в индукции дифференцировки клеток как основного сигнального пути, отвечающего за коммуникацию эндотелиальных клеток с подлежащими клетками мезенхимного происхождения. В проекте будут использованы первичные эндотелиальные клетки человека из различных источников: пуповинной вены, аорты, аортального клапана, и первичные клетки человека мезенхимного происхождения: мезенхимные стволовые клетки жировой ткани, гладкомышечные клетки аорты, интерстициальные клетки аортального клапана. Полученные результаты позволят сделать выводы о роли взаимодействия эндотелиальных клеток с клетками мезенхимного происхождения, а также вкладе активации сигнального пути Notch в процесс дифференцировки мезенхимных клеток.
18-29-17074 «Нановолокнистые 3D-скаффолды на основе полисахаридов для тканевой инженерии»; руководитель Скорик Ю. А.
Создание материалов с заданными свойствами – актуальная задача современной химии и материаловедения. Данный проект посвящен разработке и созданию нетканых скаффолдов для роста клеток на основе природных биосовместимых и биорезорбируемых полисахаридов, полученных методом электроформования.
На сегодняшний день электроформование нановолокон из растворов полимеров – один из самых распространенных методов, позволяющих получать наноразмерные матрицы для различных применений. Диаметр получаемых нановолокон соответствует размеру межклеточного матрикса. Одним из подходов к регулированию свойств конечных материалов является получение композитных материалов на основе смеси полимеров или полимерной матрицы с нанонаполнителем. Композитный материал обладает свойствами обоих компонентов.
В данном проекте предполагается получение композитных нетканых скаффолдов путем последовательного формования растворов биополимеров, а также формования смеси растворов биополимеров с нанофибриллами хитина, полислойных на основе сочетания слоев поликислот и хитозана и модификации волокон путем введения в формовочные растворы нанонаполнителя – модифицированных наночастиц (нанофибриллы) хитина. Будут исследованы физико-химические свойства полученных скаффолдов (влагоудерживающая способность и прочностные свойства), а также их общая токсичность, влияние на адгезию и пролиферацию клеток. Планируется изучить влияние электростатических взаимодействий полимеров и нанонаполнителя, формирования ПЭК на процесс электроформования и свойства скаффолдов.
18-315-20050 «Разработка метода изучения нейрогенной регуляции малого круга кровообращения и ремоделирования легочной артерии и обоснование нового метода лечения легочной гипертензии путем селективного воздействия на нервные элементы»; руководитель Михайлов Е. Н.
Сосуды легких иннервируются симпатическими и парасимпатическими нервными волокнами. Располагаясь преимущественно в проксимальных отделах легочной артерии, симпатические нервные волокна влияют на величину легочного сосудистого сопротивления и податливость (жесткость) легочной артерии. Вышеперечисленные показатели тесно взаимосвязаны с тяжестью гемодинамических нарушений и прогнозом при легочной гипертензии.
В пилотных исследованиях показано, что признаком, косвенно отражающим изменения структуры и иннервации сосудов малого круга кровообращения, может служить реакция на электрическую стимуляцию легочной артерии. Степень выраженности этой реакции зависит от плотности нервных окончаний и тонуса симпатической нервной системы. В свою очередь изменение вазодвигательных реакций может быть отражением структурных изменений сосудистой стенки. Цель настоящего исследования – изучить вазомоторные реакции сосудов малого круга кровообращения и механизмы их реализации в ответ на электрическую стимуляцию легочной артерии, а также установить связь вегетативных реакций со структурными изменениями легочной артерии в норме и в условиях легочной гипертензии.
По результатам исследования планируется получить базовые предпосылки, необходимые для разработки метода лечения с помощью селективной денервации легочной артерии.
19-015-00313 «Механизмы участия ламина А в дифференцировке стволовых клеток»; руководитель Костарева А. А.
Проект направлен на решение фундаментальной проблемы биологии развития и медицины – исследование роли белков ламинов типа А/C в дифференцировке клеток. Целью проекта является изучение механизмов участия ламина А в дифференцировке клеток.
Будут использованы резидентные мезенхимные стволовые клетки и индуцированные плюрипотентные стволовые клетки с моделированными мутациями в гене ламина А/C, либо полученные непосредственно от пациентов с верифицированным ламинопатиями и мутациями в гене ламина А/C. Будет изучено взаимодействие ламина A c внутриклеточными сигнальными путями, опосредующими дифференцировку клеток. Предполагается оценить, какие именно сигнальные пути вовлечены во взаимодействие с ламином А в ходе клеточной дифференцировки. Будут получены линии стволовых клеток (мезенхимных и индуцированных плюрипотентных) от пациентов с верифицированными мутациями в гене LMNA и клинически подтвержденными ламинопатиями. Работа мутантного ламина в клетках также будет смоделирована при помощи внесения мутантного гена на лентивирусном носителе в первичные культуры клеток мезенхимного происхождения. При запуске дифференцировки в адипогенном, остеогенном либо кардиогенном направлении будет произведена оценка активации/инактивации сигнальных путей Wnt, Notch, TGF-beta, BMP в зависимости от наличия/отсутствия мутации в гене LMNA и таким образом выявлены сигнальные пути и гены, с которыми взаимодействует ламин А в ходе дифференцировки.
19-29-01066 «Методы анализа больших неструктурированных данных для разработки системы оценки прогноза восстановления интегративной функции мозга и создания методов лечения в условиях нарушенного сознания — сочетания выпадения и новой патологической интеграции организма»; руководитель Кондратьева Е. А.
В основе предполагаемого научного исследования лежит следующая гипотеза: сознание является результатом интегративной деятельности целостного организма. При отсутствии сознания из такой генерации выпадают функциональные системы как реализующие феномен сознания (например, двигательные), так и обеспечивающие поддержание адекватной молекулярно-клеточной жизнедеятельности головного мозга (от сердечно-сосудистой до иммунной системы организма). Нарушение сознания, в зависимости от тяжести, клинически проявляется выпадением функций. Но такие выпадения всегда сопровождаются новой организацией (интеграцией) оставшихся функций. Полная утрата такой организации (смерть мозга) в настоящее время юридически признается биологической смертью организма.
В работе предполагается изучить различные варианты интеграции организма при нарушении сознания. На основе анализа устойчивых состояний, заносимых в историю болезни в медицинских информационных системах (данных клинических исследований, интраскопических с функциональными программами, нейроэндокринных, метаболомов мозга, генетических) будут разработаны новые, более чувствительные и специфические методики прогнозирования исхода с возможностью более высокой организации функций. Выявление вариантов патологической организации жизнедеятельности организма у этих больных (аллостаз) послужит основанием для разработки новых методик лечения. На основе анализа слабоструктурированных данных электронных медицинских систем при помощи методов машинного обучения возможно прогнозирование клинических событий, а также анализ и интерпретация устойчивых состояний мозга на основе разнородных, слабоструктурированных медицинских данных.
17-15-01292 «Структурно-молекулярные механизмы дисфункции канала Nav1.5 в миокарде»; руководитель Жоров Б. С. (ответственный исполнитель — Костарева А. А.)
Нарушения ритма сердца являются важной медицинской проблемой. Во многих случаях нарушения ритма обусловлены наследственными или de novo мутациями в натриевых каналах Nav1.5, которые отвечают за начальную (0) фазу потенциала действия в кардиомиоцитах. Основная цель данного проекта состоит в том, чтобы лучше понять структурные молекулярные механизмы, которые лежат в основе натриевых каналопатий в миокарде.
Наследственные мутации в каналах вызывают патологические состояния – каналопатии. В частности, мутации в Nav1.5 и Nav1.1/Nav1.2 каналах вызывают нарушения сердечного ритма и эпилепсии соответственно. В рамках проекта будет проведено секвенирование Nav1.5 (SCN5A) генов у больных с нарушениями ритма сердца. Данные этих экспериментов будут проанализированы биоинформатическими методами с целью выявления мутаций, потенциально ответственных за нарушения свойств канала Nav1.5. Наиболее вероятные мутации-кандидаты будут исследованы в гомологических моделях Nav1.5, построенных с использованием последних рентгеноструктурных и криоэлектронно-микроскопических структур гомологичных натриевых, кальциевых и калиевых каналов. Зависящие от состояния канала контакты будут выявлены и проанализированы путем сравнения Монте-Карло минимизированной энергии моделей закрытого и открытого состояний Nav1.5 и соответствующих мутантов. Гипотезы будут проверены посредством экспрессии в клетках НЕК-293 или CHO-K1 мутантных форм Nav1.5, предположительно вызывающих каналопатии, а также Nav1.5 с мутациями в зависящих от состояния канала контактах, анализа электрофизиологических свойств мутантов и их сравнения с характеристиками канала дикого типа.
17-75-30052 «Разработка персонализированной терапии ожирения и сахарного диабета 2 типа в целях снижения сердечно-сосудистых рисков»; руководитель Шляхто Е. В. (ответственный исполнитель — Бабенко А. Ю.)
Сахарный диабет 2 типа (СД2), развивающийся в основном на фоне висцерального ожирения, – социально значимое заболевание, снижение потерь от которого относится к приоритетным направлениям в развитии современной медицины. Переход к персонифицированному выбору терапии является основным путем решения этой проблемы.
В современных алгоритмах принятие решения о выборе лечения как ожирения, так и СД2 строится на подборе «идеальных кандидатов» на тот или иной вариант лечения, что не всегда оказывается эффективным, так как при этом не учитываются психологические особенности, тип пищевого поведения, генетические предикторы, функциональное состояние инсулярного аппарата и уровень гормонов, регулирующих углеводный обмен, комфортность каждого вида лечения для пациента. Это влияет не только на эффективность, но и на приверженность пациентов к терапии, и на долговременность сохранения целевых параметров, что определяет сердечно-сосудистый прогноз. Создание аналитической программы/технологии принятия решения, основанной на максимальном количестве данных и учете перечисленных особенностей и предикторов ответа на терапию, а также с учетом динамики пластичных молекулярно-генетических маркеров, отражающих влияние выбранного варианта терапии на сердечно-сосудистую систему, позволит с наиболее высокой вероятностью достигнуть целевых показателей с максимальным улучшением сердечно-сосудистого прогноза и, при сохранении безопасности лечения, обеспечит персонализацию лечения. Реализация проекта позволит максимально рационально использовать лекарственные препараты, минимизируя число ошибок при выборе лечения.
18-14-00152 «Молекулярно-генетические механизмы кальцификации сердца и сосудов»; руководитель Малашичева А. Б.
Проект направлен на выяснение ранних механизмов активации остеогенной дифференцировки, приводящих к кальцификации тканей сердца и сосудов. Образование костной ткани и патологическая кальцификация тканей сердца и сосудов имеют сходные признаки – в особенности на продвинутых стадиях. Пусковые механизмы, которые приводят к патологической кальцификации сердца и сосудов, остаются во многом неисследованными, а ранние маркеры остеогенеза неизвестными. Кальцификация клапанов сердца является распространенным сердечно-сосудистым осложнением, и на сегодняшний день консервативного лечения этой патологии не существует. Механизмы возникновения кальцификации клапанов и аорты остаются неясными. Целью данного проекта является выявление молекулярно-клеточных и генетических механизмов, приводящих к индукции остеогенной дифференцировки в тканях аортального клапана сердца и аорты. В проекте предполагается использование интерстициальных и эндотелиальных клеток аортального клапана, эндотелиальных и гладкомышечных клеток аорты, а также мезенхимных мультипотентных стромальных клеток жировой ткани. В ходе выполнения проекта будут идентифицированы ранние молекулярные маркеры остеогенной дифференцировки в изучаемых клеточных системах; будет выяснена роль межклеточных взаимодействий в индукции проостеогенных генов; проведен анализ роли ряда сигнальных путей в индукции остеогенной дифференцировки; проведено сравнение клеток, полученных от здоровых людей и от пациентов с кальцификацией аортального клапана по способности этих клеток к остеогенной дифференцировке. Будет изучена роль пуринергического сигналинга в индукции остеогенеза в клетках аортального клапана; роль внеклеточного матрикса в индукции остеогенной дифференцировки клеток. При помощи секвенирования нового поколения когорты пациентов с кальцификацией аортального клапана будет оценен вклад генетической составляющей на возникновение кальцификации. Такой комплексный подход обеспечит получение принципиально новых знаний о механизмах инициации процессов кальцификации и остеогенной дифференцировки в норме и при патологии. План предлагаемого проекта получил одобрение локального этического комитета НМИЦ им. В. А. Алмазова. Все исследования с участием физических лиц будут проведены в соответствии с Хельсинской декларацией. Выполнение данного проекта позволит сделать выводы о ранних инициаторных механизмах кальцификации аортального клапана и аорты, сходствах или различиях этого процесса в клетках клапана и аорты с остеогенной дифференцировкой мезенхимных мультипотентных стромальных стволовых клеток, о роли сигнальных путей, связанных с индукцией остеогенеза, роли пуринергического сигналинга в активации проостеогенных механизмов в норме и при патологии. Получение таких данных важно для понимания фундаментальных механизмов инициации остеогенной дифференцировки как с целью предотвращения такой дифференцировки, так и с целью ее активации при соответствующих патологиях.
16-15-10178 «Исследование механизмов нарушения регенерации скелетной мускулатуры и патологического замещения функциональной мышечной ткани на жировую»; руководитель Дмитриева Р. И.
Выявление молекулярных механизмов регуляции патологического замещения функциональной мышечной ткани на жировую ткань по-прежнему остается серьезной нерешенной проблемой фундаментальной медицины.
Основной гипотезой, которую мы проверяем в данном проекте, является предположение о том, что развитие жировой и мышечной тканей регулируется согласованно, адипогенные и миогенные сигнальные пути апрегулированы при нормальном развитии и росте скелетной мускулатуры и при заболеваниях, характеризующихся патологическим замещением функциональной ткани скелетной мускулатуры на жировую, нарушается баланс стимуляции адипогенных и миогенных сигнальных путей. Гипотеза сформировалась в ходе работы над проектом No16-15-10178, в результате которой нами были получены новые данные о согласованной регуляции миогенных и адипогенных транскрипционных программ в ходе развития и регенерации скелетной мускулатуры. Результаты, полученные для клеточной линии миобластов мыши С2С12, были в целом подтверждены исследованиями с использованием первичных культур сателлитных клеток мышечной ткани мыши, а также сателлитных клеток мышечной ткани человека и мезенхимных предшественников мышечной ткани человека.
В данном проекте мы планируем преодолеть этот недостаток, получив воспроизводимую модель мышечной дифференцировки из индуцированных плюрипотентных клеток человека (iPSC). iPSC-модель мышечной дифференцировки будет получена из мононуклеаров пациентов с мышечными дистрофиями, обусловленными мутациями в генах, кодирующих белки LINC-комплекса. Образцы iPSC здоровых доноров были получены в нашем институте ранее и хранятся в биобанке Центра.
Вторая линия исследований также сформировалась на основании данных, полученных нами в ходе выполнения проекта № 16-15-10178. Данные свидетельствуют о том, что R482L мутация гена ламина стимулирует формирование жировых отложений в миобластах и миотрубках, одновременно вызывая гипертрофию мышечного волокна, что хорошо сочетается с разнообразием фенотипов мышечных патологий у пациентов с семейной парциальной липодистрофией Дюннингана (FPLD2). Поэтому в данном проекте мы планируем изучение роли изменений в структуре LMNA-DNA регуляторных комплексов, обусловленных мутацией LMNA-R482L, и выявление механизмов жировой дегенерации при FPLD2. Данная серия экспериментов будет выполнена с использованием миобластов мыши С2С12, генетически модифицированных лентивирусными конструкциями LMNA-R482L.
17-75-10125 «Исследование роли гена синемина (SYNM) в дифференцировке мезенхимных стромальных клеток и формировании врожденных пороков развития»; руководитель Злотина А. М.
Белки промежуточных филаментов представляют собой обширную группу белков цитоскелета, участвующих в поддержании структурной и механической целостности клетки, а также вовлеченных в ряд других ключевых клеточных функций. Известно, что дефекты в генах промежуточных филаментов могут приводить к развитию тяжелых наследственных патологий, многие из которых затрагивают ткани мезенхимального происхождения, в том числе миопатий и кардиомиопатий, липодистрофий, некоторых патологий скелета, сложных синдромальных сочетаний.
Настоящий проект нацелен на исследование роли гена SYNM, кодирующего промежуточный филамент синемин, в дифференцировке мультипотентных мезенхимных стромальных клеток и на исследование функциональной значимости его генетических вариантов. В частности, полученные данные позволят оценить эффект ранее не охарактеризованного генетического варианта синемина, выявленного нами у пациентки с фенотипом ульнарно-маммарного синдрома, на дифференцировку стромальных мезенхимных клеток, что поможет расширить представления о молекулярно-клеточных механизмах развития комплексных врожденных дефектов, затрагивающих ткани мезенхимного происхождения, а также о спектре клинических патологий, ассоциированных с мутациями в генах промежуточных филаментов.
18-75-10042 «Изучение предикторов постпрандиального гликемического ответа и потребности в инсулинотерапии у женщин с гестационным сахарным диабетом с целью персонализации подходов к его лечению»; руководитель Пустозеров Е. А.
Цель работы – изучить предикторы постпрандиального гликемического ответа (ППГО) и потребности в инсулинотерапии у женщин с гестационным сахарным диабетом (ГСД) с целью персонализации подходов к лечению и создать интерактивное мобильное приложение для женщин с ГСД.
I этап – изучение предикторов, построение и тестирование моделей прогнозирования ППГО и потребности в инсулинотерапии у женщин с ГСД; разработка интерактивного мобильного приложения для женщин с ГСД.
II этап – рандомизированное контролируемое исследование применения интерактивного мобильного приложения для женщин с ГСД.
Планируется: создать базу данных пациенток с ГСД на основе заполняемых электронных дневников самоконтроля; провести валидизацию электронных дневников питания по суточной экскреции биомаркеров в моче; изучить состав кишечного микробиома у женщин с ГСД и женщин с нормальной толерантностью к глюкозе; изучить вклад характеристик кишечного микробиома в ППГО; изучить роль генетических вариаций генов, регулирующих секрецию инсулина и ассоциированных с инсулинорезистентностью, в прогнозировании ППГО; изучить роль генетических вариаций генов, регулирующих секрецию инсулина и ассоциированных с инсулинорезистентностью, и характеристик кишечного микробиома в прогнозировании потребности в инсулинотерапии у женщин с ГСД; построить модели прогнозирования ППГО у женщин с ГСД на разных сроках беременности; разработать интерактивное мобильное приложение со встроенными формулами для прогнозирования ППГО в реальном времени; провести рандомизированное исследование влияния применения интерактивного мобильного приложения на показатели гликемического контроля у женщин с ГСД и исходы беременности.
18-75-00006 «Исследование ассоциации редких и укорачивающих вариантов в гене тайтина с вариантом течения постинфарктного ремоделирования миокарда»; руководитель Киселёв А. М.
Целью данного проекта является выявление редких и укорачивающих вариантов гена тайтина, которые могут влиять на течение постинфарктного ремоделирования миокарда. Исследование будет проведено на готовой к анализу, описанной и охарактеризованной группе, состоящей из пациентов, перенесших острый инфаркт миокарда (600 пациентов). Тема постинфарктного ремоделирования и выявления генов, ответственных за этот процесс, в последнее время привлекает большое количество исследователей. Опубликовано несколько работ, описывающих патогенные варианты различных структурных, z-диск-ассоциированных и регуляторных генов в связи с дилатацией миокарда. Среди них большое внимание уделено влиянию укорачивающих вариантов гена тайтина на течение различных кардиологических заболеваний. Наличие таких вариантов в 2-4 % условно здоровой популяции может говорить в пользу отсутствия их прямого патогенного влияния на течение заболевания. Тем не менее исследований, показывающих достоверную связь и изучающих влияние укорачивающих вариантов тайтина с дилатацией камер сердца на фоне состояния после острого инфаркта миокарда, до сих пор не проводилось.
Основная задача проекта заключается в изучении ассоциации укорачивающих и редких патогенных вариантов гена тайтина и варианта течения постинфарктного ремоделирования миокарда. Для выполнения поставленной задачи будут использованы технологии секвенирования нового поколения с целевым обогащением, биоинформатические методы анализа данных. Отдельное внимание будет уделяться статистической обработке полученных данных и выявлению взаимосвязей между наличием укорачивающих и редких патогенных вариантов гена тайтина и развитием дилатации миокарда, связанной с постинфарктным ремоделированием. На основе полученных данных будут сделаны выводы о наличии взаимосвязи между присутствием редких и укорачивающих вариантов гена тайтина и риском развития дилатации и хронической сердечной недостаточности у пациентов, перенесших острый инфаркт миокарда. Научная новизна представленного проекта определяется тем, что:
1) в литературе отсутствуют исследования, позволяющие выявить взаимосвязь между укорачивающими и редкими вариантами гена тайтина и вариантом развития постинфарктного ремоделирования миокарда;
2) полученные данные вместе с современными технологиями генетического тестирования позволят разработать персонализированные подходы к лечению пациентов, перенесших острый инфаркт миокарда;
3) полученные данные создадут задел для будущих функциональных исследований взаимосвязи наличия редких и укорачивающих вариантов тайтина с патогенезом различных кардиологических заболеваний
19-75-20076 «Молекулярные основы участия субпопуляций внеклеточных везикул в развитии системного воспалительного ответа, инициированного повреждением элементов сердечно-сосудистой системы»; руководитель Головкин А. С.
Проект направлен на изучение механизмов регуляции посредством внеклеточных везикул системного воспалительного ответа (СВО), развивающегося при повреждении элементов сердечно-сосудистой системы. Конкретной задачей проекта является характеристика (фенотип, молекулярный состав, иммуногенные свойства) субпопуляций циркулирующих в крови внеклеточных везикул при повреждении элементов сердечно-сосудистой системы и оценка их вклада в регуляцию системного воспалительного ответа. Актуальность проблемы определяется распространенностью сердечно-сосудистых заболеваний, которые являются ведущей причиной смертности и инвалидности в мире. А также ключевой ролью системного воспалительного ответа, развивающегося в ответ на повреждение и определяющего дальнейшее течение заболевания, его осложнения и исходы. В исследовании будут изучаться две группы пациентов, которым выполнялось аортокоронарное шунтирование (АКШ), проводимое с использованием искусственного кровообращения (ИК) и без такового, животные модели повреждения миокарда в результате ишемии-реперфузии (крысы) и криоповреждения (Danio rerio), а также животные (Danio rerio) и клеточные (культура моноцитов человека THP-1) модели развития иммунного ответа. Научная новизна проекта заключается в применении комплексного подхода, сочетающего современные методы молекулярной и клеточной биологии, клинической и экспериментальной медицины для детального изучения внеклеточных везикул в уникальных образцах биологического материала пациентов и нескольких модельных системах. Проточная цитометрия высокого разрешения будет применена для изучения гетерогенности совокупности циркулирующих внеклеточных везикул, основанной на присутствии в их составе определенного набора поверхностных маркеров, а направленный иммуносортинг позволит оценивать молекулярный состав, иммуногенность и вклад в патогенез отдельно взятых субпопуляций везикул. Свойства конкретных субпопуляций везикул будут определены посредством детекции биомолекул в их составе, включая количественный анализ митохондриальной ДНК и микроРНК, а также широкомасштабное профилирование уровней коротких РНК с помощью секвенирования нового поколения. Функциональный анализ иммуногенных свойств субпопуляций везикул будет произведен как в системе in vitro, так и in vivo в модели иммунного ответа Danio rerio. Анализ фенотипов, молекулярного состава и иммуногенных свойств внеклеточных везикул, циркулирующих в крови на различных этапах повреждения элементов сердечно-сосудистой системы, позволит определить их роль в регуляции системного воспалительного ответа, а также получить информацию о биомаркерах осложненного и неосложненного течения СВО и потенциальных терапевтических мишенях.
19-75-00070 «Роль киназы GSK3B в ремоделировании структуры вставочных дисков кардиомиоцитов в норме и при патологии»; руководитель Худяков А. А.
Вставочные диски кардиомиоцитов необходимы для образования прочной механической связи между кардиомиоцитами и обеспечения электропроводности ткани миокарда. В последнее время интерес к структуре и функции вставочных дисков существенно вырос, поскольку обнаружилось, что вставочные диски выполняют роль механосенсоров, а также участвуют во внутриклеточном сигналинге. Известно более двухсот белков, ассоциированных со вставочными дисками, изменения в которых приводят к развитию заболеваний сердца, наиболее распространенным среди которых является аритмогенная кардиомиопатия – генетически и фенотипически гетерогенное заболевание. Разнообразие генетических детерминант, приводящих к развитию схожего фенотипа заболевания, позволяет предположить, что изменения на молекулярном уровне могут инициироваться в различных компартментах клетки, но в дальнейшем приводить к характерному для аритмогенной кардиомиопатии нарушению структуры вставочных дисков. Одним из кандидатов на роль переносчика сигнала между вставочным диском и внутриклеточным пространством является GSK3B-киназа. Существуют данные о том, что ингибиторы GSK3B-киназы способны предотвращать развитие аритмогенной кардиомиопатии на животных моделях, однако детальные молекулярные механизмы этого эффекта остаются неизученными.
Настоящее исследование направлено на изучение роли GSK3B-киназы в регуляции структуры вставочного диска в норме и при аритмогенной кардиомиопатии. Особое внимание планируется уделить ионным каналам, ассоциированным со вставочным диском, и электрической функции кардиомиоцита. В ходе исследования будет проведено генетическое исследование пациентов с аритмогенной кардиомиопатией, получены пациент-специфичные индуцированные плюрипотентные клетки и при помощи дифференцированных из индуцированных плюрипотентных стволовых клеток кардиомиоцитов проверены гипотезы о влиянии активации и ингибирования GSK3B на электрофизиологические характеристики кардиомиоцитов и изучена роль GSK3B в регуляции транспорта и мембранной локализации отдельных компонентов вставочных дисков.
075-15-2019-161 «Разработка персонифицированных подходов к терапии артериальной гипертензии с учетом молекулярно-генетических и цитокиновых маркеров, нейрогенных влияний, органных поражений и метаболических расстройств»; руководитель Конради А. О.
Проект посвящен изучению механизмов повышения уровня артериального давления и субклинического поражения органов-мишеней при ожирении на молекулярно-генетическом и клеточном уровнях с поиском новых мишеней и трансляцией результатов экспериментальных исследований в клинику.
Перспективным представляется изучение роли вырабатываемых жировой тканью биологически активных пептидов – цитокинов (адипокинов), а также влияние повышенной активности симпатической нервной системы. В качестве потенциальной клеточной мишени адипокинов были выбраны два ионных канала: катионный канал TRPC и натриевый эпителиальный канал ENaC. Предположительно эти каналы могут быть мишенью воздействия адипокинов и вовлечены в развитие субклинического поражения органов-мишеней и артериальной гипертензии при ожирении.
В рамках проекта будет изучена роль адипокинов в регуляции TRPC-каналов подоцитов гломерул нефрона и ENaC-дистального отдела нефрона. Планируется оценить изменения функциональной активности каналов в подоцитах гломерул нефрона и в клетках дистального отдела нефрона под влиянием выбранных адипокинов. Перспективным молекулярно-генетическим маркером ожирения и распределения жировой ткани является ген FTO, а именно носительство А аллеля rs9939609 полиморфизма гена FTO. Распределение жировой ткани может играть важную роль в сохранении метаболического здоровья у пациентов с ожирением. В проекте впервые будет оцениваться изменение различных параметров и факторов при уменьшении активности симпатической нервной системы в рамках проспективного наблюдения у пациентов с ожирением и резистентной гипертензией, прошедших процедуру радиочастотной абляции почечных симпатических нервов.
2023 год
Biocomposite films based on chitosan and cerium oxide nanoparticles with promising regenerative potential Valentina A. Petrova, Natallia V. Dubashynskaya, Iosif V. Gofman, Alexey S. Golovkin, Alexander I. Mishanin, Arthur D. Aquino, Daria V. Mukhametdinova, Alexandra L. Nikolaeva, Elena M. Ivan’kova, Alexander E. Baranchikov, Alexander V. Yakimansky, Vladimir K. Ivanov, Yury A. Skorik. International Journal of Biological Macromolecules. 2023. Vol. 229. P. 329-343. DOI: 10.1016/j.ijbiomac.2022.12.305 Scopus Q1/Q2 IF 8,872
Modulation of Notch Signaling at Early Stages of Differentiation of Human Induced Pluripotent Stem Cells to Dopaminergic Neurons. Nataliia V. Katolikova, Aleksandr A. Khudiakov, Daria D. Shafranskaya, Andrey D. Prjibelski, Alexey E. Masharskiy, Mikael S. Mor, Alexey S. Golovkin, Anastasia K. Zaytseva, Irina E. Neganova, Evgeniya V. Efimova, Raul R. Gainetdinov, Anna B. Malashicheva. International Journal of Molecular Sciences. 2023. Vol. 24, № 2. 1429. DOI: 10.3390/ijms24021429. Scopus Q1/Q2 IF6,208
Chitosan Composites with Bacterial Cellulose Nanofibers Doped with Nanosized Cerium Oxide: Characterization and Cytocompatibility Evaluation. Valentina A. Petrova, Iosif V. Gofman, Natallia V. Dubashynskaya, Alexey S. Golovkin, Alexander I. Mishanin, Elena M. Ivan’kova, Dmitry P. Romanov, Albert K. Khripunov, Elena N. Vlasova, Alexandra V. Migunova, Alexander E. Baranchikov, Vladimir K. Ivanov, Alexander V. Yakimansky, Yury A. Skorik. International Journal of Molecular Sciences. — 2023. Vol. 24, № 6. 5415. DOI: 10.3390/ijms24065415. Scopus Q1/Q2 IF 6,208
Brevetoxin versus Brevenal Modulation of Human Nav1 Channels. Rocio K. Finol-Urdaneta, Boris S. Zhorov, Daniel G. Baden, David J. Adams. Marine Drugs. 2023. Vol. 21, № 7. 396. DOI: 10.3390/md21070396. Scopus Q1/Q2 IF 6,085
Desmin mutations impact the autophagy flux in C2C12 cell in mutation-specific manner. K. S. Sukhareva, N. A. Smolina, A. I. Churkina, K. K. Kalugina, S. V. Zhuk, A. A. Khudiakov, A. A. Khodot, G. Faggian, G. B. Luciani, T. Sejersen, A. A. Kostareva. Cell and Tissue Research. 2023. Vol. 393. P. 357-375. DOI: 10.1007/s00441-023-03790-6. Scopus Q1/Q2 IF 4,4
Mechanisms of dihydropyridine agonists and antagonists in view of cryo-EM structures of calcium and sodium channels. Denis B. Tikhonov, Boris S. Zhorov. Journal of General Physiology. 2023. Vol. 155, № 11. e202313418. DOI: 10.1085/jgp.202313418. Scopus Q1/Q2 IF 4,372
In silico analysis of TRPM4 variants of unknown clinical significance. Tarnovskaya SI, Kostareva AA, Zhorov BS… PLoS ONE. 2023. Vol. 18, № 12. e0295974. DOI: 10.1371/journal.pone.0295974. Scopus Q1/Q2 IF 3,752
miR-21, miR-93, miR-191, miR-let-7b, and miR-499 expression level in plasma and cerebrospinal fluid in patients with prolonged disorders of consciousness . Tatiana A Petrova, Sergey A Kondratyev, Anna A Kostareva, Roman V Rutkovskiy, Irina A Savvina, Ekaterina A Kondratyeva. Neurology International. 2023. Vol. 15, № 1. P. 40-54. DOI: 10.3390/neurolint15010004. Scopus Q3/Q4 IF 2,483
Значение традиционных факторов риска сердечно-сосудистых заболеваний в фенотипических проявлениях гипертрофической кардиомиопатии. Ежова А.В., Зайцев В.В., Ишмухаметов Г.И., Андреева С.Е., Антонова А.П., Даутов Д.Р., Конасов К.С., Гурщенков А.В., Гордеев М.Л., Костарева А.А., Моисеева О.М. Артериальная гипертензия. 2023. Т. 29, № 4. С. 371-379. DOI: 10.18705/1607-419X-2023-29-4-371-379. Scopus Q3/Q4. IF 1,78
Информативность ключевых молекулярных маркеров при моделировании бронхолегочной дисплазии. Лозовская Е.А., Костарева А А, Петрова Н А. Russian Biomedical Research. 2023. Т. 8, № 2. С. 18-24. DOI: 10.56871/RBR.2023.26.59.003 IF 1,644
Особенности клинического течения кардио миопатий на фоне укорачивающих вариантов в гене TTN: обзор литературы и анализ клинических случаев. Вахрушев Ю.А., Андреева С.Е., Яковлевна Г.А., Ковальчук Т.С., Алексеева Д.Ю., Ходот А.А., Васичкина Е.С., Язневич О.О., Борцова М.А., Костарева А.А…Трансляционная медицина. 2023. Т. 10, № 5. С. 430-448. DOI: 10.18705/2311—4495-2023-10-5-430-448. IF 0,864
Petrova Valentina A., Dubashynskaya Natallia V., Gofman Iosif V. et al. Biocomposite films based on chitosan and cerium oxide nanoparticles with promising regenerative potential // International Journal of Biological Macromolecules. – 2023. – Vol. 229. – P. 329–343.
Petrova Valentina A., Gofman Iosif V., Dubashynskaya Natallia V. et al. Chitosan Composites with Bacterial Cellulose Nanofibers Doped with Nanosized Cerium Oxide: Characterization and Cytocompatibility Evaluation // International Journal of Molecular Sciences. – 2023. – Vol. 24, № 6. – Р. 5415.
Katolikova Nataliia V., Khudiakov Aleksandr A., Shafranskaya Daria D. et al. Modulation of Notch Signaling at Early Stages of Differentiation of Human Induced Pluripotent Stem Cells to Dopaminergic Neurons // International Journal of Molecular Sciences. – 2023. – Vol. 24, № 2. – Р. 1429.
Petrova Tatiana A, Kondratyev Sergey A, Kostareva Anna A et al. miR-21, miR-93, miR-191, miR-let-7b, and miR-499 expression level in plasma and cerebrospinal fluid in patients with prolonged disorders of consciousness // Neurology International. – 2023. – Vol. 15, № 1. – P. 40–54.
Kaplina, A., Kononova, S., Petrova, N. et al. Necrotizing Enterocolitis: The Role of Hypoxia, Gut Microbiome, and Microbial Metabolites // International Journal of Molecular Sciences. – 2023. – Vol. 24, № 3. – Р. 2471.
Sukhareva K. S., Smolina N. A., Churkina A. I. et al. Desmin mutations impact the autophagy flux in C2C12 cell in mutation-specific manner // Cell and Tissue Research. – 2023. – Vol. 393. – P. 357–375.
2022 год
Generation of iPSC line FAMRCi010-A from patient with restrictive cardiomyopathy carrying genetic variant FLNC p.Gly2011Arg. Kseniya Perepelina, Aleksandr Khudiakov, Nataliia Rodina, Aleksandr Boytsov, Tatiana Vavilova, Anna Zlotina, Polina Sokolnikova, Anna Kostareva//Stem Cell Research., 2022 doi: 10.1016/j.scr.2021.102639, IF Scopus 1,835, НЦМУ №075-15-2020-901 Шляхто Е. В.
Generation of iPSC line (FAMRCi009-A) from patient with familial progressive cardiac conduction disorder carrying genetic variant FLNC p.Val2264Met. Nataliia Rodina, Aleksandr Khudiakov, Kseniya Perepelina, Aleksey Muravyev, Aleksandr Boytsov, Anna Zlotina, Polina Sokolnikova, Anna Kostareva//Stem Cell Research., 2022 doi: 10.1016/j.scr.2021.102640, IF Scopus 1,835, Грант РНФ №20-15-00271 от 20.05.2020 Костарева А. А.
Case report: two new cases of autosomal-recessive hypertrophic cardiomyopathy associated with TRIM63-compound heterozygous variant. Andreeva Sofiya, Chumakova Olga, Karelkina Elena, Lebedeva Viktoriya, Lubimtseva Tamara, Semenov Andrey, Nikitin Alexey, Speshilov Gleb, Kozyreva Alexandra, Sokolnikova Polina, Zhuk Sergey, Fomicheva Yuliya, Moiseeva Olga, Kostareva Anna//Frontiers in genetics., 2022 doi: 10.3389/FGENE.2022.743472, IF Scopus 4.274, IF WOS 4,599, НЦМУ №075-15-2020-901 Шляхто Е. В.
Characterization of the novel heterozygous SCN5A genetic variant Y739D associated with Brugada syndrome. Anastasia K. Zaytseva, Artem M. Kiselev, Alexander S. Boitsov, Yulia V. Fomicheva, Georgii S. Pavlov, Boris S. Zhorov, Anna A. Kostareva//Biochemistry and Biophysics Reports., 2022 doi.org/10.1016/j.bbrep.2022.101249, IF Scopus 3,01, НЦМУ №075-15-2020-901 Шляхто Е. В.
Case report: loss-of-function ABCC9 genetic variant associated with ventricular fibrillation. Anastasia K. Zaytseva, Tatyana E. Tulintseva, Yulya V. Fomicheva, Valeria B. Mikhailova1, Tatiana V. Treshkur, Anna A. Kostareva// Frontiers in genetics., 2022 doi.org/10.3389/fgene.2022.718853, IF Scopus 4.274, IF WOS 4,599, НЦМУ №075-15-2020-901 Шляхто Е. В.
Relationship between the levels of lncRNA H19 in plasma and different adipose tissue depots with patients’ response to bariatric surgery. Artemyeva M.S., Vasileva L.B., Ma Y., Kondratov K.A., Fedorov A.V., Kostareva A.A., Lapshina S.E., Anopova A.D., Likhonosov N.P., Neymark A.E., Babenko A.Yu., Shlyakhto E.V.// Life., 2022 doi.org/10.3390/life12050633, IF Scopus 3,778, IF WOS 3,251, НЦМУ №075-15-2020-901 Шляхто Е. В.
Application of machine learning methods to analyze occurrence and clinical features of ascending aortic dilatation in patients with and without bicuspid aortic valve. Irtyuga O, Kopanitsa G, Kostareva A, Metsker O, Uspensky V, Gordeev M, Faggian G, Sefieva G, Derevitskii I, Malashicheva A, Shlyakhto E.// Journal of Personalized Medicine., 2022 doi.org/10.3390/jpm12050794, IF Scopus 4,945, НЦМУ №075-15-2022-301 Шляхто Е. В.
A study of the genomic variations associated with autistic spectrum disorders in a russian cohort of patients using whole-exome sequencing. Gibitova E.A., Dobrynin P.V., Pomerantseva E.A., Musatova E.V., Kostareva A., Evsyukov I., Rychkov S.Y., Zhukova O.V., Naumova O.Y., Grigorenko E.L.// Genes., 2022 doi.org/10.3390/genes13050920, IF Scopus 3,868, НЦМУ №075-15-2022-301 Шляхто Е. В.
LMNA mutation leads to cardiac sodium channel dysfunction in the Emery-Dreifuss muscular dystrophy patient. Perepelina K., Zaytseva A., Khudiakov A., Neganova I., Vasichkina E., Malashicheva A., Kostareva A.// Frontiers in Cardiovascular Medicine., 2022 doi.org/10.3389/fcvm.2022.932956, IF Scopus 8,2, IF WOS 5,846, НЦМУ №075-15-2022-301 Шляхто Е. В.
Transient neurochemical features of the perigeniculate neurons during early postnatal development of the cat. Merkulyeva N., Mikhalkin A., Kostareva A., Vavilova T.// Journal of Comparative Neurology., 2022 doi.org/10.1002/cne.25402, IF WOS 3,028
2021 год
Dubashynskaya NV, Raik SV, Dubrovskii YA, et al. Hyaluronan/colistin polyelectrolyte complexes: Promising antiinfective drug delivery systems. Int J Biol Macromol. 2021;187:157-165. doi:10.1016/j.ijbiomac.2021.07.114. IF 6.782. Режим доступа: https://pubmed.ncbi.nlm.nih.gov/34298050/
Вахрушев Ю.А., Куулар А.А., Лебедева В.К., Козырева А.А., Костарева А.А., Ситникова М.Ю., Лясникова Е.А. Варианты гена RBM20, ассоциированные с дилатацией левого предсердия у пациентов с постинфарктным кардиосклерозом и сердечной недостаточностью с низкой фракцией выброса. Российский кардиологический журнал. 2021;26 (10):4707. doi:10.15829/1560—4071-2021-4707. IF 2.128. Режим доступа: https://russjcardiol.elpub.ru/jour/article/view/4707?locale=ru_RU
Гудкова А.Я., Стрельцова А.А., Костарева А.А. Гипертрофическая кардиомиопатия: современные возможности фармакологических подходов к лечению. Терапевтический архив. 2021; 91 (9): 129-136. DOI: 10.26442/00403660.2019.09.000137. IF 1,559. Режим доступа: https://ter-arkhiv.ru/0040—3660/article/view/33672
Гудкова А.Я., Лапекин С.В., Бежанишвили Т.Г., Шляхто Е.В. [и др.] AL-амилоидоз с преимущественным поражением сердца. Алгоритм неинвазивной диагностики амилоидной кардиомиопатии. Терапевтический архив.2021; 93 (4): 487-496. DOI: 10.26442/00403660.2021.04.200689. IF 1.559. Режим доступа: https://ter-arkhiv.ru/0040—3660/article/view/71263/ru_RU
Вахрушев Ю.А., Козырева А.А., Жук С.В., Ротарь О.П., Костарева А.А. Анализ частоты и спектра вариантов в гене тайтина в условно здоровой российской популяции. Трансляционная медицина. 2021;8 (5):29-37. doi:10.18705/2311—4495-2021-8-5-29-37. IF 0,61. Режим доступа: https://transmed.almazovcentre.ru/jour/article/view/637
Sukhareva, K., Smolina, Natalia, Knyazeva, Anastasia, Kalugina, K., Khudyakov, A., Kostareva, Anna. The Effect of Mutation of L345P in the Desmin Gene on the Process of Autophagy in Muscle Cells of the C2C12 Line. Cell and Tissue Biology. 2021; 15. 34-43. DOI:10.1134/S1990519X21010119. IF 0.591. Режим доступа: https://www.elibrary.ru/item.asp?id=43039577
Kalugina, K.K., Sukhareva, K.S., Churkinа, A.I. et al. Autophagy as a Pathogenetic Link and a Target for Therapy of Musculoskeletal System Diseases. J Evol Biochem Phys 57, 666–680 (2021). DOI:10.1134/S0022093021030145. IF 0.292. Режим доступа: https://link.springer.com/article/10.1134/S0022093021030145#citeas
Theodoris CV, Zhou P, Liu L, et al. Network-based screen in iPSC-derived cells reveals therapeutic candidate for heart valve disease. Science. 2021;371 (6530):eabd0724. doi:10.1126/science.abd0724. IF 41.845. Режим доступа: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7880903/
Steenblock C, Richter S, Berger I, et al. Viral infiltration of pancreatic islets in patients with COVID-19. Nat Commun. 2021;12 (1):3534. Published 2021 Jun 10. doi:10.1038/s41467-021-23886-3. IF 13.783. Режим доступа: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8192507/
de Abreu MS, Demin KA, Giacomini ACVV, et al. Understanding how stress responses and stress-related behaviors have evolved in zebrafish and mammals. Neurobiol Stress. 2021;15:100405. Published 2021 Sep 29. doi:10.1016/j.ynstr.2021.100405. IF 7.181. Режим доступа: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8536782/
2020 год
Titov A, Valiullina A, Zmievskaya E, et al. Advancing CAR-T-cell therapy for solid tumors: lessons learned from lymphoma treatment. Cancers. 2020;12 (1):125. IF 6,13. Режим доступа: https://pubmed.ncbi.nlm.nih.gov/31947775/
Kondratov K, Nikitin Y, Fedorov A, et al. Heterogeneity of the nucleic acid repertoire of plasma extracellular vesicles demonstrated using high-sensitivity fluorescence-activated sorting. Journal of extracellular vesicles. 2020;9 (1):1743139. IF 15,00. IF 6,20. Режим доступа: https://pubmed.ncbi.nlm.nih.gov/32341769/
Kudryavtseva V, Stankevich K, Kozelskaya A, et al. Magnetron plasma mediated immobilization of hyaluronic acid for the development of functional double-sided biodegradable vascular graft. Applied Surface Science. 2020;529:147196. IF 6,20. Режим доступа: https://www.sciencedirect.com/science/article/pii/S016943322031953X
Malashicheva A, Kostina A, Kostareva A, et al. Notch signaling in the pathogenesis of thoracic aortic aneurysms: A bridge between embryonic and adult states. Biochimica et Biophysica Acta — Molecular Basis of Disease. 2020;1866 (3):165631. Режим доступа: https://www.sciencedirect.com/science/article/pii/S092544391930359X?via%3Dihub
Semenova D, Bogdanova M, Kostina A, et al. Dose-dependent mechanism of Notch action in promoting osteogenic differentiation of mesenchymal stem cells. Cell and Tissue Reseach. 2020;379 (1):169-179. Режим доступа: https://link.springer.com/article/10.1007/s00441-019-03130-7
Smolina N, Khudiakov A, Knyazeva A, et al. Desmin mutations result in mitochondrial dysfunction regardless of their aggregation properties. Biochim Biophys Acta Mol Basis Dis. 2020;1866 (6):165745. Режим доступа: https://www.sciencedirect.com/science/article/pii/S0925443920300909?via%3Dihub
Barbitoff YA, Polev DE, Glotov AS, et al. Systematic dissection of biases in whole-exome and whole-genome sequencing reveals major determinants of coding sequence coverage. Sci Rep. 2020;1 (1):2057. Режим доступа: https://www.nature.com/articles/s41598-020-59026-y
2019 год
Fedorov A, Kondratov K, Kishenko V, et al. Application of high-sensitivity flow cytometry in combination with low-voltage scanning electron microscopy for characterization of nanosized objects during platelet concentrate storage. 2019;31 (2):226-235. Режим доступа: https://www.tandfonline.com/doi/abs/10.1080/09537104.2019.1599337?journalCode=iplt20&
Korkosh VS, Kiselev AM, Mikhaylov EN, et al. Atomic mechanisms of Timothy syndrome-associated mutations in calcium Channel Cav1.2. Frontiers in physiology. 2019;10:ID335. Режим доступа: https://www.frontiersin.org/articles/10.3389/fphys.2019.00335/full
Zaytseva, AK; Karpushev, AV; Kiselev, AM; Mikhaylov, EN; Lebedev, DS; Zhorov, BS; Kostareva, AA. Characterization of a novel SCN5A genetic variant A1294G associated with mixed clinical phenotype. Biochemical and biophysical research communications. 2019;516 (3):777-783. Режим доступа: https://www.sciencedirect.com/science/article/pii/S0006291X19312161
Lelyavina TA; Galenko VL; Ivanova OA; et al. Clinical response to personalized exercise therapy in heart failure patients with reduced ejection fraction is accompanied by skeletal muscle histological alterations. International journal of molecular sciences. 2019;20 (21):ID 5514/ Режим доступа: https://www.mdpi.com/1422—0067/20/21/5514
Khudiakov AA; Smolina NA; Perepelina KI; et al. Extracellular MicroRNAs and mitochondrial DNA as potential biomarkers of arrhythmogenic cardiomyopathy. Biochemistry-Moscow. 2019;84 (3):272-282. Режим доступа: https://link.springer.com/article/10.1134/S000629791903009X
Kostina A, Semenova D, Kostina D, et al. Human aortic endothelial cells have osteogenic Notch-dependent properties in co-culture with aortic smooth muscle cells. Biochemical and biophysical research communications. 2019;514 (2):462-468. Режим доступа: https://www.sciencedirect.com/science/article/pii/S0006291X19308344?via%3Dihub
Андрющенко А.В., Арутюнов Г.П., Атьков О.Ю. и др. Кардиология. Национальное руководство. Краткое издание. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2018. 816 с. Режим доступа: https://elibrary.ru/item.asp?id=30508803
Акчурин Р.С., Алексеева Ю.А., Алекян Б.Г. и др. Кардиология. Национальное руководство. . 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2015. 800 с. Режим доступа: https://elibrary.ru/item.asp?id=25970918
Семернин Е.Н., Гудкова А.Я., Крутиков А.Н. и др. Поражение сердца при гемохроматозе (алгоритмы диагностики и врачебная тактика). СПб.: Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова, 2014. 52 с. Режим доступа: https://elibrary.ru/item.asp?id=30345736
Семернин Е.Н., Гудкова А.Я., Шляхто Е.В. и др. Первичные и вторичные кардиомиопатии (морфо-функциональные и клинико-генетические параллели. Современное представление). Пособие для студентов старших курсов, клинических ординаторов и врачей-кардиологов. СПб.: Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова, 2008. 76 с. Режим доступа: https://elibrary.ru/item.asp?id=29240743
Приборно-материальная и методическая база
Адрес: Санкт-Петербург, ул. Аккуратова, д. 2, Главный клинический комплекс, 18 этаж
телефон: + 7 (812) 702-37-77
