Клинические исследования и доказательная медицина



 Большакова Ольга Олеговна
Большакова Ольга Олеговна
Начальник отдела клинических исследований, д.м.н.
В 2006 году в ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России был создан отдел клинических исследований с целью организации, координации, осуществления методического руководства и контроля проведения исследований.
В задачи отдела были включены:
- разработка нормативной базы проведения исследований в рамках Центра,
Для заказчиков клинических исследований
- организация обучения сотрудников правилам Надлежащей клинической практики (GCP),
- взаимодействие с регулирующими структурами и фирмами-заказчиками,
- взаимодействие с Этическим комитетом,
- развитие системы проведения доклинических и клинических исследований
в Центре Алмазова в целом.
В 2010 году отдел клинических исследований был преобразован в научно-исследовательское подразделение. Это обусловлено тем, что процесс организации проведения клинических исследований (КИ) лекарственных препаратов в Центре — лишь часть, хотя и весьма значительная, работы отдела.
ул. Аккуратова, д. 2, 20 этаж, каб. 1.20.26
Телефон/факс: +7 (812) 702-37-42
Е-mail: cr@almazovcentre.ru
Одним из важнейших элементов, обеспечивающих качество работы в области клинических исследований, является квалификация сотрудников. Исследователь может быть высококвалифицированным специалистом в своей области, но из-за недостатка информации в области Надлежащей клинической практики (GCP — Good Clinical Practice), законодательной базы Российской Федерации, касающейся проведения клинических исследований лекарственных препаратов, возможны ошибки и отклонения от протокола. Задачу обучения и повышения квалификации исследователей в области проведения клинических исследований решают циклы тематического усовершенствования «Основы проведения клинических исследований», организованные совместно с отделом постдипломного образования.
С 2011 года Центр Алмазова начал проведение выездных циклов.
В связи с расширением спектра услуг и открытием нового подразделения — отделения ранних фаз клинических исследований, в 2014 году было создано научно-клиническое объединение «Центр клинических исследований».
Нормативно-правовые акты
С 2016 года отделом клинических исследований проводятся исследования отечественных инсулинов (гиперинсулинемические эугликемические клэмп-тесты у здоровых добровольцев и больных сахарным диабетом).
С 2017 года – исследования в педиатрии (детская гематология, кардиология, неврология). Среди диагностических исследований: КТ, МРТ, ПЭТ/КТ, функциональная диагностика (эхокардиография, ЭКГ, бодиплетизмография, эргоспирометрия), офтальмология.
С 2019 году Центр Алмазова включен в перечень организаций, имеющих право проводить клинические испытания медицинских изделий в рамках ЕврАзЭС.
Основными направлениями в области клинических исследований в 2019 году стали испытания медицинских изделий, область гематологии и кардиологии.
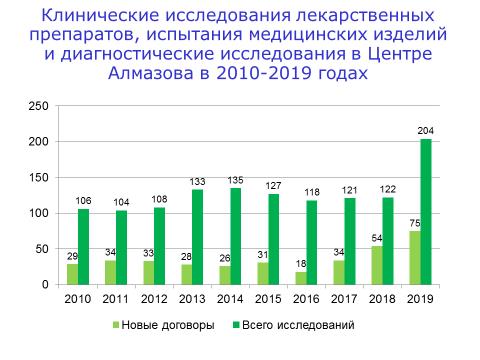
В 2019 году в отделе максимально возросло число новых договоров по всем направлениям – КИ лекарственных препаратов, испытания медицинских изделий и проведение диагностических исследований в рамках КИ лекарственных препаратов, в том числе для внешних центров (КТ, МРТ, ПЭТ, лабораторная диагностика, офтальмологическое обследование, функциональная диагностика).
2020 год также стал рекордсменом по числу договоров. Работы проводились по 207 договорам, проходившим через научно-исследовательский отдел. Всего заключено в 2020 году 47 договоров новых, из них 25 — клинические исследования лекарственных препаратов, 6 — диагностические исследования в рамках КИ и 16 — испытания медицинских изделий.
Средства, получаемые Центром Алмазова от юридических лиц по договорам о проведении клинических исследований лекарственных препаратов, испытаний медицинских изделий используются в соответствии с Положением о распределении внебюджетных средств (заработная плата, включая социальные налоги и взносы – 70 %, фонды учреждения – 30 %).
В 2020 году проводятся 2 исследования у пациентов с новой коронавирусной инфекцией:
- Р-Фарм «Международное многоцентровое рандомизированное двойное слепое адаптивное плацебо-контролируемое исследование эффективности и безопасности однократного введения препаратов Олокизумаб и RPH-104 на фоне стандартной терапии у пациентов с тяжелой инфекцией, вызванной вирусом SARS-CoV-2 (COVID-19)» фаза 2/3;
- Биокад «Многоцентровое рандомизированное двойное-слепое плацебо-контролируемое с адаптивным дизайном клиническое исследование эффективности и безопасности препарата левилимаб (BCD-089) у пациентов c тяжелым течением COVID-19», фаза 3.
Свидетельство об аккредитации на право проведения клинических исследований
Свидетельство об аккредитации на право проведения клинических исследований
биомедицинских клеточных продуктов
О включении в перечень медицинских организаций, имеющих право проводить клинические и (или) клинико-лабораторные испытания (исследования) медицинских изделий с целью оценки их безопасности и клинической эффективности в целях регистрации (ЕврАзЭс)
Лицензия на осуществление медицинской деятельности
Положение о проведении клинических исследований лекарственных препаратов в ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России
Нормативные документы по клиническим исследованиям
Архивирование документов клинических исследований
Для врача-исследователя
Обзоры
Изменение названия учреждения:
Письмо в организации о смене названия и реквизитов
Приказ о назначении генерального директора
Лист записи Единого государственного реестра юридических лиц
Свидетельство о постановке на учет в налоговом органе
Изменения, которые вносятся в Устав
Приказ № 419 о внесении изменений в Устав
Приказ об утверждении Устава
Устав
